Kumpulan Latihan soal kimia sma kelas x ( 10 ) dan pembahasan | Latihan soal kimia sma kelas 1
Kumpulan Latihan soal kimia sma kelas x ( 10 ) dan pembahasan. Pada kesempatan kali ini sengaja kami buatlatihan soal kimia dan pembahasannya untuk adik adik yang masih duduk di kelas x sebagai pengenalan mengenai pelajaran kimia. langsung saja disimak semoga dapat bermanfaat
1. Zat yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana melalui reaksi kimia biasa disebut...
a. Unsur
b. Molekul
c. Atom
d. Senyawa
e. Partikel
Jawab : A
2. Ilmuwan yang berhasil menemukan elektron dan model atom yang menyerupai roti kismis adalah...
a. Niels Bohr
b. Ernest Rutherford
c. J.J Thomson
d. J. Chadwik
e. Max Planck
Jawab : C
3. Sebuah atom memiliki jumlah elektron 7 dan nomor massanya 19. Berapakah jumlah neutron pada atom tersebut?
a. 7
b. 19
c. 10
d. 12
e. 14
Jawab : 12
Jumlah proton = jumlah elektron = 7
Jumlah neutron = nomor massa – jumlah proton
= 19 – 7 = 12
4. Dalam satu golongan, besarnya jari-jari atom dari atas ke bawah adalah...
a. Berkurang
b. Bertambah
c. Tetap
d. Mengecil
e. Tidak berubah
Jawab : B
5. Sifat-sifat unsur yang berubah secara beraturan seiring pertambahan nomor atomnya disebut...
a. Sifat golongan
b. Sifat unsur
c. Sifat khas
d. Sifat periodik
e. Sifat koligatif
Jawab : D
6. Suatu ikatan dimana pasangan elektron yang dipakai bersama tertarik lebih kuat ke salah satu atom disebut...
a. Ikatan ion
b. Ikatan kovalen polar
c. Ikatan van der Wals
d. Ikatan kovalen koordinat
e. Ikatan logam
Jawab : B
7. Ikatan kimia pada senyawa air adalah jenis ikatan...
a. Ikatan hidrogen
b. Ikatan ion
c. Ikatan kovalen
d. Ikatan logam
e. Ikatan van der Waals
Jawab : Ikatan hidrogen
8. Dibawah ini merupakan senyawa yang memiliki ikatan homopolar, kecuali...
a. NaOH
b. HCl
c. HF
d.
e.
Jawab : A
9. 25 gram gas
a. 22,4 L
b. 11,2 L
c. 12,5 L
d. 12 L
e. 24 L
Jawab : B
V = mol × 22,4 = 11,2 L
10. Berapakah massa dari
a. 0,2 gram
b. 0,3 gram
c. 0,5 gram
d. 0,15 gram
e. 0,35 gram
Jawab : A
Massa Ca = mol x Ar = 0,005mol x 40 = 0,2 gram
11. “Unsur-unsur yang membentuk senyawa selalu bereaksi dalam perbandingan massa yang sudah tertentu dan tetap” Hukum tersebut merupakan bunyi dari hukum...
a. Hukum kekekalan massa
b. Hukum kekekalan energi
c. Hukum perbandingan tetap
d. Hukum perbandingan terbalik
e. Hukum gas ideal
Jawab : C
12. Jika Ar H=1, O=16, dan C=12. Maka dalam 0,50 mol
a. 12 gram
b. 1 gram
c. 6 gram
d. 31 gram
e. 16 gram
Jawab : C
Massa
13. Suatu gas memiliki volume 56 L pada suhu 0°C dan tekanan 1 atm. Gas tersebut memiliki massa175 gram. Jika rumus empiris senyawa adalah
a.
b.
c.
d.
e.
Jawab : A
Rumus molekul =
= (14)n = 70
n = 5
14. Suatu tabung berisi gas
a.
b.
c.
d.
e.
Jawab : C
15. “Pada suhu dan tekanan sama, semua gas bervolume sama mengandung jumlah molekul yang sama pula.” Hukum dasar kimia diatas dikemukakan oleh...
a. Joseph Louis Proust
b. Amadeo Avogadro
c. Antonie Laurent Lavoisier
d. Dalton
e. Gay - Lussac
Jawab : B
16. Suatu zat dikatakan sebagai zat elektrolit jika...
a. Derajat ionisasinya mendekati 1
b. Derajat ionsasinya mendekati nol
c. Derajar ionisasinya negatif
d. Derajat ionisasinya sama dengan nol
e. Tidak memiliki derajat ionisasi
Jawab : A
17. Diketahui
a. 35,2
b. 35,8
c. 35,1
d. 35,5
e. 35,0
Jawab : D
18. Bilangan oksidasi Sulfur dalam
a. +2
b. +3
c. +6
d. +18
e. +32
Jawab : C
Biloks S + biloks O = -2
Biloks S + (4 x (-2)) = -2
Biloks S = +6
19. Senyawa-senyawa yang berbeda tetapi mempunyai rumus molekul yang sama disebut...
a. Polimer
b. Isomer
c. Isoalkana
d. Dimer
e. Monomer
Jawab : B
20. Untuk jumlah atom karbon yang sama, perbandingan titik didih antara alkana, alkena dan alkuna adalah...
a. Alkana > alkena < alkuna
b. Alkana <alkena < alkuna
c. Alkana > alkena > alkuna
d. Alkana = alkena = alkuna
e. Alkana< alkena >alkuna
Jawab : C
Soal kimia kelas 11 dan pembahasannya | Soal Kimia kelas xi dan pembahasannya . Semoga dapat bermanfaat buat adik adik siswa kelas xi. selamat belajar
1. Terletak di periode dan golongan berapakah unsur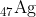 ?
?
Unsur perak (Ag) terletak pada periode 5 dan golongan IB
2. Berapakah jumlah pasangan elektron total dari molekul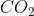 ?
?
a. 2 domain
b. 3 doman
c. 4 domain
d. 0 domain
e. 1 domain
Jawab : A
molekul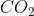
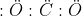
Pasangan elektron ikatan : 2 domain
Pasangan elektron bebas : 0 domain
Total pasangan elektron : 2 domain
3. Suatu sistem meneriMa kalor sebesar 90 kJ dan dikenakan kerja sebesar 100 kJ. Berapa perubahan energi dalam pada sistem tersebut?
a. +10 kJ
b. -10 kJ
c. -190 kJ
d. +190 kJ
e. + 90 kJ
Jawab : D
q = +90 kJ
W = +100 kJ
∆E = q + w
∆E = 90 kJ + 100 kJ
∆E = + 190 kJ
4. Diketahui suatu reaksi :
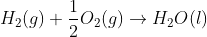
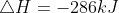
Jika reasi tersebut dibalik dan koefisien reaksi dibuat menjadi dua kali lipat, maka besar ∆H adalah...
a. -572 kJ
b. -286 kJ
c. +572 kJ
d. +286 kJ
e. -143 kJ
Jawab : C
Jika reaksi dibalik, maka tanda pada ∆H juga dibalik, sehingga nilai ∆H menjadi +286 kJ Jika koefisien reaksi dibuat menjadi dua kali lipat, maka nilai ∆H juga dikalikan 2, sehingga:
∆H = 2 (+286 kJ) = +572 kJ
5. Diketahui :
∆H°f CH3OH (l) = -238,6 kJ/mol
∆H°f CO2 (g) = -393,5 kJ/mol
∆H°f H2O (l) = -286 kJ / mol
Dari data diatas, berapakah besar entalpi pembakaran standar dari metanol?
a. -238,6 kJ/mol
b. -479,5 kJ/mol
c. -726,9 J/mol
d. -441 kJ/mol
e. -632 kJ/mol
Jawab : C
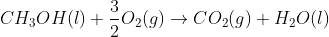
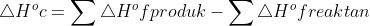
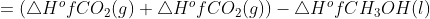
= (-393,5 kJ / mol + 2 (-286 kJ / mol)) – (-238,6 )
= -726,9 kJ / mol
6. Laju reaksi suatu gas diyatakan dengan![v = k [A]^{2}[B] v = k [A]^{2}[B]](http://latex.codecogs.com/gif.latex?v&space;=&space;k&space;[A]%5E%7B2%7D[B]) bila volume diperkecil menjadi
bila volume diperkecil menjadi  kali volume semula, maka laju reaksi jika dibandingkan dengan laju reaksi mula-mula adalah...
kali volume semula, maka laju reaksi jika dibandingkan dengan laju reaksi mula-mula adalah...
a. 64 k
b.4 k
c. 16 k
d. k
k
e.0,5 k
Jawab : A
Volume menjadi kali = konsentrasi menjadi 4 kali.
kali = konsentrasi menjadi 4 kali.
![v = k [A]^{2}[B] v = k [A]^{2}[B]](http://latex.codecogs.com/gif.latex?v&space;=&space;k&space;[A]%5E%7B2%7D[B])
![v = k[4]^{2}[4] v = k[4]^{2}[4]](http://latex.codecogs.com/gif.latex?%5Cdpi%7B100%7D&space;v&space;=&space;k[4]%5E%7B2%7D[4])
v = 64 k
7.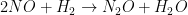
Percobaan :

Dari data di atas, berapakah orde rekasi NO?
a. 2
b.1
c. 0
d.3
e. 4
Jawab : A
![\frac{v_{1}}{v_{2}}= \frac{k [NO]^x [H_{2} ]^{y}}{k [NO]^x [H_2 ]^y} \frac{v_{1}}{v_{2}}= \frac{k [NO]^x [H_{2} ]^{y}}{k [NO]^x [H_2 ]^y}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B100%7D&space;%5Cfrac%7Bv_%7B1%7D%7D%7Bv_%7B2%7D%7D=&space;%5Cfrac%7Bk&space;[NO]%5Ex&space;[H_%7B2%7D&space;]%5E%7By%7D%7D%7Bk&space;[NO]%5Ex&space;[H_2&space;]%5Ey%7D)

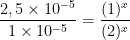
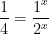
x = 2
8. Tentukan satuan k pada persamaan dibawah ini :
![v = k [A][B]^{2} v = k [A][B]^{2}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B100%7D&space;v&space;=&space;k&space;[A][B]%5E%7B2%7D)
a.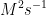
b.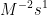
c.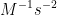
d.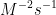
e.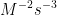
Jawab : D
![v = k [A][B]^{2} v = k [A][B]^{2}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B100%7D&space;v&space;=&space;k&space;[A][B]%5E%7B2%7D) ]
]
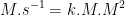
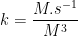
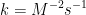
9.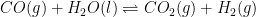
Bila pada suhu 27°C, diketahui reaksi tersebut mempunyai Kp sebesar 0,2 atm. Berapa nilai Kc?
a. Kc = 2 Kp
b.Kc = Kp
c. Kc = Kp
Kp
d.Kc = 0,25 Kp
e. Kc = 4 Kp
Jawab : B
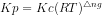
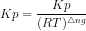
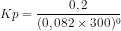
Kp = 0,2 atm
Kp = Kc
10. Diketahui reaksi sebagai berikut :
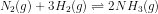
Bila pada keadaan setimbang terdapat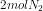 ,
, 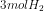 , dan
, dan 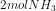 dalam wadah 1 L.
dalam wadah 1 L.
Berapakah nilai Kc?
a. Kc =
b.Kc =
c. Kc =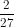
d.Kc =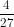
e. Kc =
Jawab : C
![[N_{2}] = \frac{mol}{L}=\frac{2}{1}=2M](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[N_%7B2%7D]&space;=&space;%5Cfrac%7Bmol%7D%7BL%7D=%5Cfrac%7B2%7D%7B1%7D=2M)
![[H_{2}] = \frac{mol}{L}=\frac{3}{1}=3M](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H_%7B2%7D]&space;=&space;%5Cfrac%7Bmol%7D%7BL%7D=%5Cfrac%7B3%7D%7B1%7D=3M)
![[NH_{3}] = \frac{mol}{L}=\frac{2}{1}=2M](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[NH_%7B3%7D]&space;=&space;%5Cfrac%7Bmol%7D%7BL%7D=%5Cfrac%7B2%7D%7B1%7D=2M)
![Kc=\frac{[NH_{3}]^{2}}{[N_{2}][H_{2}]^{3}}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;Kc=%5Cfrac%7B[NH_%7B3%7D]%5E%7B2%7D%7D%7B[N_%7B2%7D][H_%7B2%7D]%5E%7B3%7D%7D)
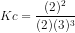
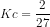
11. Di bawah ini merupakan faktor-faktor yang mempengaruhi pergeseran konsentrasi, kecuali..
a. Bila pereaksi ditambahkan, kesetimbangan bergeser ke arah produk
b.Bila volume dikurangi, kesetimbangan bergeser ke arah ruas yang memiliki jumlah mol
c. Bila tekanan ditambahkan, kesetimbangan bergeser ke arah ruas yang memiliki jumlah
d.Bila suhu ditingkatkan, kesetimbangan bergeser ke arah reaksi endoterm
e. Kesetimbangan tidak dipengaruhi oleh penambahan atau pengurangan volume
Jawab : B
12. Berapakah pH dari HCl yang memiliki konsentrasi 0,06 M?
a. 2
b.2+log 3
c. 2-log 3
d.2-log 6
e. 2-log 3
Jawab : D
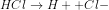
0,06 M 0,06 M 0,06 M
![[H^{+}] = a \times M](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H%5E%7B+%7D]&space;=&space;a&space;%5Ctimes&space;M)
![[H^{+}] = 1 \times 0,06 M](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H%5E%7B+%7D]&space;=&space;1&space;%5Ctimes&space;0,06&space;M)
![[H^{+}] = 0,06 M= 6\times 10^{-2}M](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H%5E%7B+%7D]&space;=&space;0,06&space;M=&space;6%5Ctimes&space;10%5E%7B-2%7DM)
![pH=-log[H^{+}]](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;pH=-log[H%5E%7B+%7D])
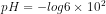
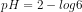
13.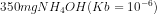 dilarutkan dalam air hingga volume 1 L. Berapakah pH larutan tersebut?
dilarutkan dalam air hingga volume 1 L. Berapakah pH larutan tersebut?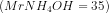
a. 10
b.4
c. 14
d.12
e. 9
Jawab : A
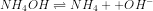

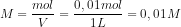
![[OH^{-}] = \sqrt{kb\times M}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[OH%5E%7B-%7D]&space;=&space;%5Csqrt%7Bkb%5Ctimes&space;M%7D)
![[OH^{-}] = \sqrt{10^{-6}\times 10^{-2}}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[OH%5E%7B-%7D]&space;=&space;%5Csqrt%7B10%5E%7B-6%7D%5Ctimes&space;10%5E%7B-2%7D%7D)
![[OH^{-}] = \sqrt{10^{-8}}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[OH%5E%7B-%7D]&space;=&space;%5Csqrt%7B10%5E%7B-8%7D%7D)
![[OH^{-}] = {10^{-4}}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[OH%5E%7B-%7D]&space;=&space;%7B10%5E%7B-4%7D%7D)
![pOH = -log[OH^{-}]](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;pOH&space;=&space;-log[OH%5E%7B-%7D])

pOH = 4
pH = pKw – pOH
pH = 14 – 4
pH = 10
14. Suatu keadaan dimana asam dan basa tepat habis bereaksi dalam proses titrasi dinamakan...
a. Titik ekivalen
b.Titik akhir titrasi
c. Titik kritis
d.Titik indikator berubah warna
e. Titik didih
Jawab : A
15. Materi penyusun larutan penyangga atau buffer adalah..
a. Asam kuat dan asam lemah
b.Basa kuat dan basa lemah
c. Basa kuat dan garamnya
d.Asam lemah dan garamnya
e.Asam kuat dan basa kuat
Jawab : D
16. Sebuah larutan mengandung 0,1 mol asam asetat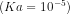 dan mengandung natrium asetat sebanyak 0,01 mol. Berapakah pH dari larutan tersebut?
dan mengandung natrium asetat sebanyak 0,01 mol. Berapakah pH dari larutan tersebut?
a. 4-log 1
b.4,0
c. 4,9
d.4+log 1
e. 4-log 2
Jawab : B
![[H^{+}] = Ka \frac{mol asam}{mol garam}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H%5E%7B+%7D]&space;=&space;Ka&space;%5Cfrac%7Bmol&space;asam%7D%7Bmol&space;garam%7D)
![[H^{+}] = 10^{-5} \frac{0,1mol}{0,01mol}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H%5E%7B+%7D]&space;=&space;10%5E%7B-5%7D&space;%5Cfrac%7B0,1mol%7D%7B0,01mol%7D)
![[H^{+}] = 10^{-4}](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;[H%5E%7B+%7D]&space;=&space;10%5E%7B-4%7D)
![pH = - log [H^{+}]](http://latex.codecogs.com/gif.latex?%5Cdpi%7B80%7D&space;pH&space;=&space;-&space;log&space;[H%5E%7B+%7D])
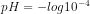
pH = 4
17. Zat dibawah ini yang terhidrolisis sempurna di dalam air adalah..
a. Barium klorida
b.Ammonium karbonat
c. Sodium asetat
d.Ammonium sulfat
e. Sodium klorida
Jawab : B
18. Dalam 2 L larutan, AgCl dapat larut sebanyak 2,87 mg. Berapakah kelarutan perak klorida dalam mol / liter? (Mr AgCl = 143,5)
a.
b.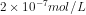
c.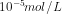
d.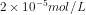
e.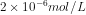
Jawab : C
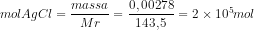
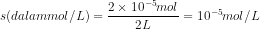
19. Nama koloid untuk fase terdispersi gas dan fase pendispersi cair adalah..
a. Aerosol cair
b.Aerosol padat
c. Buih
d.Emulsi
e. Sol
Jawab : C
20. Berikut ini adalah pembuatan koloid dengan cara kondensasi, kecuali...
a. Reaksi redoks
b.Hidrolisis
c. Dekomposisi rangkap
d.Peptisasi
e. Reaksi netralisasi
Jawab : D
1. Terletak di periode dan golongan berapakah unsur
a. Periode 5 golongan IXA
b. Peridoe 5 golongan IIA
c. Periode 4 Golongan IB
d. Periode 5 Golongan IB
e. Periode 2 golongan
Jawab : B Unsur perak (Ag) terletak pada periode 5 dan golongan IB
2. Berapakah jumlah pasangan elektron total dari molekul
a. 2 domain
b. 3 doman
c. 4 domain
d. 0 domain
e. 1 domain
Jawab : A
molekul
Pasangan elektron ikatan : 2 domain
Pasangan elektron bebas : 0 domain
Total pasangan elektron : 2 domain
3. Suatu sistem meneriMa kalor sebesar 90 kJ dan dikenakan kerja sebesar 100 kJ. Berapa perubahan energi dalam pada sistem tersebut?
a. +10 kJ
b. -10 kJ
c. -190 kJ
d. +190 kJ
e. + 90 kJ
Jawab : D
q = +90 kJ
W = +100 kJ
∆E = q + w
∆E = 90 kJ + 100 kJ
∆E = + 190 kJ
4. Diketahui suatu reaksi :
Jika reasi tersebut dibalik dan koefisien reaksi dibuat menjadi dua kali lipat, maka besar ∆H adalah...
a. -572 kJ
b. -286 kJ
c. +572 kJ
d. +286 kJ
e. -143 kJ
Jawab : C
Jika reaksi dibalik, maka tanda pada ∆H juga dibalik, sehingga nilai ∆H menjadi +286 kJ Jika koefisien reaksi dibuat menjadi dua kali lipat, maka nilai ∆H juga dikalikan 2, sehingga:
∆H = 2 (+286 kJ) = +572 kJ
5. Diketahui :
∆H°f CH3OH (l) = -238,6 kJ/mol
∆H°f CO2 (g) = -393,5 kJ/mol
∆H°f H2O (l) = -286 kJ / mol
Dari data diatas, berapakah besar entalpi pembakaran standar dari metanol?
a. -238,6 kJ/mol
b. -479,5 kJ/mol
c. -726,9 J/mol
d. -441 kJ/mol
e. -632 kJ/mol
Jawab : C
= (-393,5 kJ / mol + 2 (-286 kJ / mol)) – (-238,6 )
= -726,9 kJ / mol
6. Laju reaksi suatu gas diyatakan dengan
a. 64 k
b.4 k
c. 16 k
d.
e.0,5 k
Jawab : A
Volume menjadi
v = 64 k
7.
Percobaan :

Dari data di atas, berapakah orde rekasi NO?
a. 2
b.1
c. 0
d.3
e. 4
Jawab : A
x = 2
8. Tentukan satuan k pada persamaan dibawah ini :
a.
b.
c.
d.
e.
Jawab : D
9.
Bila pada suhu 27°C, diketahui reaksi tersebut mempunyai Kp sebesar 0,2 atm. Berapa nilai Kc?
a. Kc = 2 Kp
b.Kc = Kp
c. Kc =
d.Kc = 0,25 Kp
e. Kc = 4 Kp
Jawab : B
Kp = 0,2 atm
Kp = Kc
10. Diketahui reaksi sebagai berikut :
Bila pada keadaan setimbang terdapat
Berapakah nilai Kc?
a. Kc =
b.Kc =
c. Kc =
d.Kc =
e. Kc =
Jawab : C
11. Di bawah ini merupakan faktor-faktor yang mempengaruhi pergeseran konsentrasi, kecuali..
a. Bila pereaksi ditambahkan, kesetimbangan bergeser ke arah produk
b.Bila volume dikurangi, kesetimbangan bergeser ke arah ruas yang memiliki jumlah mol
c. Bila tekanan ditambahkan, kesetimbangan bergeser ke arah ruas yang memiliki jumlah
d.Bila suhu ditingkatkan, kesetimbangan bergeser ke arah reaksi endoterm
e. Kesetimbangan tidak dipengaruhi oleh penambahan atau pengurangan volume
Jawab : B
12. Berapakah pH dari HCl yang memiliki konsentrasi 0,06 M?
a. 2
b.2+log 3
c. 2-log 3
d.2-log 6
e. 2-log 3
Jawab : D
0,06 M 0,06 M 0,06 M
13.
a. 10
b.4
c. 14
d.12
e. 9
Jawab : A
pOH = 4
pH = pKw – pOH
pH = 14 – 4
pH = 10
14. Suatu keadaan dimana asam dan basa tepat habis bereaksi dalam proses titrasi dinamakan...
a. Titik ekivalen
b.Titik akhir titrasi
c. Titik kritis
d.Titik indikator berubah warna
e. Titik didih
Jawab : A
15. Materi penyusun larutan penyangga atau buffer adalah..
a. Asam kuat dan asam lemah
b.Basa kuat dan basa lemah
c. Basa kuat dan garamnya
d.Asam lemah dan garamnya
e.Asam kuat dan basa kuat
Jawab : D
16. Sebuah larutan mengandung 0,1 mol asam asetat
a. 4-log 1
b.4,0
c. 4,9
d.4+log 1
e. 4-log 2
Jawab : B
pH = 4
17. Zat dibawah ini yang terhidrolisis sempurna di dalam air adalah..
a. Barium klorida
b.Ammonium karbonat
c. Sodium asetat
d.Ammonium sulfat
e. Sodium klorida
Jawab : B
18. Dalam 2 L larutan, AgCl dapat larut sebanyak 2,87 mg. Berapakah kelarutan perak klorida dalam mol / liter? (Mr AgCl = 143,5)
a.
b.
c.
d.
e.
Jawab : C
19. Nama koloid untuk fase terdispersi gas dan fase pendispersi cair adalah..
a. Aerosol cair
b.Aerosol padat
c. Buih
d.Emulsi
e. Sol
Jawab : C
20. Berikut ini adalah pembuatan koloid dengan cara kondensasi, kecuali...
a. Reaksi redoks
b.Hidrolisis
c. Dekomposisi rangkap
d.Peptisasi
e. Reaksi netralisasi
Jawab : D



Post a Comment