Pembahasan Soal Essay Nomor 1-6 Olimpiade Kimia Tahun 2014
Soal 1. Senyawa-senyawa yang mengandung atom H, N, dan O (25 poin)
Atom H, N dan O dapat membentuk 5 senyawa A, B, C, D dan E. Data yang dikumpulkan mengenai kelima senyawa itu adalah:
- Semua senyawa A, B, C, D dan E tersebut bila dilarutkan dalam air bersifat elektrolit, walaupun tidak semua merupakan elektrolit Senyawa C dan D adalah senyawa ionik tetapi senyawa B adalah kovalen
- Nitrogen dengan tingkat oksidasi tertinggi terdapat pada senyawa A dan C, sedangkan nitrogen dengan tingkat oksidasi terendah terdapat pada senyawa C, D dan Muatan formal dua atom nitrogen pada senyawa C adalah +1 tetapi muatan formal atom nitrogen pada senyawa B = 0
- Pada temperatur ruang, senyawa A dan E ada dalam larutan, dan kedua larutan tersebut dapat mengeluarkan gas-gas, Konsentrasi larutan A paling pekat 16 M sedangkan larutan E paling pekat 15
- Senyawa D mengandung nitrogen 43,7% massa dan oksigen 50% Dalam kondisi STP, senyawa D merupakan kristal padat dan bila dipanaskan akan terdekomposisi membentuk gas.
- Senyawa C mengandung satu atom O lebih banyak dari Larutan C bersifat asam lemah, larutan A adalah asam kuat. Larutan B dan E bersifat basa.
- Titrasi 0,726 g senyawa B membutuhkan HCI 1 M sebanyak 21,98 ml untuk
Tentukan rumus kimia 5 senyawa tersebut dan jelaskan cara mendapatkannya.
Pembahasan soal
Senyawa A adalah asam kuat dan atom nitrogennya punya tingkat oksidasi tertinggi. Tingkat oksidasi tertinggi N adalah +5, dan ini terdapat pada HNO3 (ini asam kuat) jadi senyawa A adalah HNO3 .
Senyawa B adalah senyawa kovalen, mutan formal atom N = 0, bersifat basa.
Titrasi senyawa B (bersifat basa – punya gugus OH) dapat dinetralkan dengan HCl 1 M sebanyak 21,98 mL
Jumlah mol HCl = 1 M x 21,98 mL = 21,98 mmol. Ini setara dengan mol senyawa B. Untuk memastikan perlu diketahui massa molar senyawa B = 0,726 g : 21,98 mmol = 33,03 g/mol
Massa molar 33 g/ mol ini sesuai dengan massa molar NH2OH = 14 + 2 + 16 + 1 = 33 g/mol
 Muatan formal dari N = 5 – 3 – 2 = 0
Muatan formal dari N = 5 – 3 – 2 = 0
Jadi senyawa B ini adalah NH2OH .
Senyawa C adalah senyawa yang memiliki 2 atom N (dengan tingkat oksidasi tertinggi (+5) dan terendah (-3)) bersifat asam lemah, senyawa ionik, muatan formal kedua atom N-nya adalah +1. N dengan tingkat oksidasi tertinggi ada pada NO3– dan tingkat oksidasi terendah ada pada NH3atau NH4+
 Tampak pada gambar kedua ion tersebut muatan formal atom N adalah +1 (muatan formal = jumlah elektron valensi – jumlah ikatan – jumlah elektron bebas). Kesimpulannya senyawa C adalah NH4NO3. Garam ini merupakan jenis garam yang bersifat asam.
Senyawa D merupakan senyawa ionik. Rumus empiris senyawa D dapat ditentukan berdasarkan data di d dan disimpukan memiliki perbandingan H:N:O = 2:1:1.
Tampak pada gambar kedua ion tersebut muatan formal atom N adalah +1 (muatan formal = jumlah elektron valensi – jumlah ikatan – jumlah elektron bebas). Kesimpulannya senyawa C adalah NH4NO3. Garam ini merupakan jenis garam yang bersifat asam.
Senyawa D merupakan senyawa ionik. Rumus empiris senyawa D dapat ditentukan berdasarkan data di d dan disimpukan memiliki perbandingan H:N:O = 2:1:1.
 Jumlah atom O pada senyawa C (NH4NO3) dinyatakan lebih banyak dibanding senyawa D, dengan demikian disimpulkan bahwa senyawa D adalah NH4NO2 (oksigennya 1 lebih sedikit dibanding senyawa C (NH4NO3) ) .
Jumlah atom O pada senyawa C (NH4NO3) dinyatakan lebih banyak dibanding senyawa D, dengan demikian disimpulkan bahwa senyawa D adalah NH4NO2 (oksigennya 1 lebih sedikit dibanding senyawa C (NH4NO3) ) .
Reaksi dekomposisi : NH4NO2 → N2 (g)+ 2 H2O (l)
Senyawa E bersifat basa, dengan tingkat oksidasi N terendah (biasanya pada ion amonium dengan tingkat oksidasi N = -3), mudah menguap pada suhu kamar. Karena ada kata kunci bersifat basa maka dapat disimpulkan senyawa E adalah NH4OH.
Jadi : A = HNO3 B = NH2OH C = NH4NO3 D = NH4NO2 E = NH4OH.
Titrasi senyawa B (bersifat basa – punya gugus OH) dapat dinetralkan dengan HCl 1 M sebanyak 21,98 mL
Massa molar 33 g/ mol ini sesuai dengan massa molar NH2OH = 14 + 2 + 16 + 1 = 33 g/mol
 Muatan formal dari N = 5 – 3 – 2 = 0
Muatan formal dari N = 5 – 3 – 2 = 0Jadi senyawa B ini adalah NH2OH .
 Tampak pada gambar kedua ion tersebut muatan formal atom N adalah +1 (muatan formal = jumlah elektron valensi – jumlah ikatan – jumlah elektron bebas). Kesimpulannya senyawa C adalah NH4NO3. Garam ini merupakan jenis garam yang bersifat asam.
Tampak pada gambar kedua ion tersebut muatan formal atom N adalah +1 (muatan formal = jumlah elektron valensi – jumlah ikatan – jumlah elektron bebas). Kesimpulannya senyawa C adalah NH4NO3. Garam ini merupakan jenis garam yang bersifat asam. Jumlah atom O pada senyawa C (NH4NO3) dinyatakan lebih banyak dibanding senyawa D, dengan demikian disimpulkan bahwa senyawa D adalah NH4NO2 (oksigennya 1 lebih sedikit dibanding senyawa C (NH4NO3) ) .
Jumlah atom O pada senyawa C (NH4NO3) dinyatakan lebih banyak dibanding senyawa D, dengan demikian disimpulkan bahwa senyawa D adalah NH4NO2 (oksigennya 1 lebih sedikit dibanding senyawa C (NH4NO3) ) .Reaksi dekomposisi : NH4NO2 → N2 (g)+ 2 H2O (l)
Soal 2. Senyawa karbonat (12 poin)
Anda mempunyai suatu garam karbonat yang kationnya tidak diketahui secara pasti. Tetapi anda ketahui pasti, kation tersebut mempunyai muatan +2. Jadi, garam tersebut mempunyai formula umum MCO3.
Sebanyak 4,56 g senyawa ini dimasukkan ke dalam air, ternyata tidak larut. Penambahan asam kuat (HCl) berlebih, dan sebagaimana diharapkan, larutan mengeluarkan gelembunggelembung gas dan senyawa tersebut menjadi larut. Massa yang hilang akibat bebasnya gas CO2 adalah 1,164 g. Selanjutnya, ke dalam larutan tersebut ditambahkan natrium fosfat, dan terbentuk endapan baru.
- Apa kation dalam garam karbonat tersebut?
- Bagaimana formula endapan baru setelah penambahan natrium fosfat?
- Berapa massa endapan baru tersebut?
Anda mempunyai suatu garam karbonat yang kationnya tidak diketahui secara pasti. Tetapi anda ketahui pasti, kation tersebut mempunyai muatan +2. Jadi, garam tersebut mempunyai formula umum MCO3.
Sebanyak 4,56 g senyawa ini dimasukkan ke dalam air, ternyata tidak larut. Penambahan asam kuat (HCl) berlebih, dan sebagaimana diharapkan, larutan mengeluarkan gelembunggelembung gas dan senyawa tersebut menjadi larut. Massa yang hilang akibat bebasnya gas CO2 adalah 1,164 g. Selanjutnya, ke dalam larutan tersebut ditambahkan natrium fosfat, dan terbentuk endapan baru.
- Apa kation dalam garam karbonat tersebut?
- Bagaimana formula endapan baru setelah penambahan natrium fosfat?
- Berapa massa endapan baru tersebut?
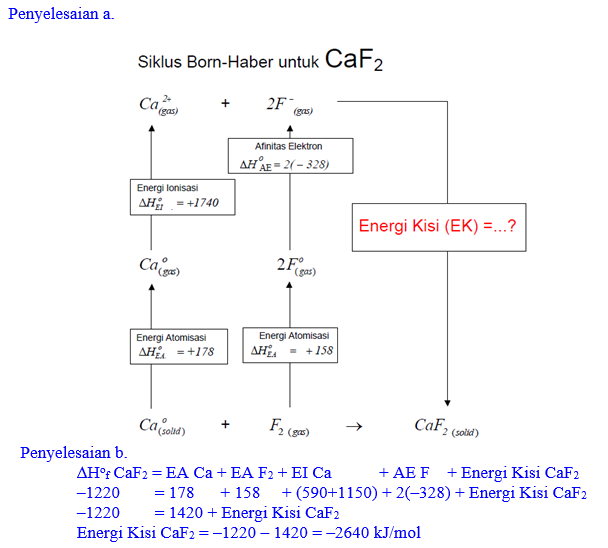
Soal 3. Mineral fluorospar ( 22 poin)
Sumber utama fluorin adalah mineral fluorospar juga disebut fluorite) yang kandungan utamanya adalah kalsium fluorida, CaF2.
- Susunlah siklus Born-Haber pembentukan CaF2 dari unsur-unsurnya.
- Gunakan siklus ini untuk menghitung energi kisi CaF2 (s), dihubungkan dengan data berikut dan data yang lain. ∆H atomisasi (Ca) = +178 kJ.mol-1; F(g) → F–(g), ∆H = -328kJ.mol-1 (afinitas elektron fluorin); ∆Hf (CaF2) = -1220 kJ.mol-1; ∆H atomisasi F2 = 158kJ.mol-1; Energi ionisasi ke 1 dan ke 2 dari Ca = 590 dan 1150 kJ.mol-1 .
- Tahap pertama pembebasan fluorin dari CaF2 adalah menghaluskan senyawa ini dan kemudian mereaksikannya dengan asam sulfat Hasil reaksi ini adalah hidrogen fluorida dan kalsium sulfat, CaSO4. Tuliskan persamaan setara dan fasa reaktan dan produk untuk reaksi ini
- Hitunglah perubahan entalpi untuk reaksi ini (‘c’), dengan menggunakan data berikut melengkapi data di atas: ∆Hf (H2SO4) = -814 mo1-1; ∆Hf (HF) = -271 kJ.mol-1; ∆Hf(CaSO4) = -1434 kJ.mol-1.
- Haruskah reaksi ini dipanaskan atau didinginkan? Berikan alasan atas jawaban Anda.


Soal 4. Aditif dalam deterjen, natrium tripolyfosfat, (23 poin)
Senyawa natrium tripolyfosfat, Na5P3O10, dihasilkan dari proses pemanasan stoikiometri dinatriumfosfat, Na2HPO4, dan mononatriumfosfat, NaH2PO4, di bawah kondisi yang terkendali. Senyawa ini digunakan sebagai aditif dalam detergen untuk mengikat ion Ca2+ dan Mg2+ dalam air sadah sehingga dapat mencegah pengendapan garam asam lemak pada pakaian yang dicuci.
- Tuliskanlah reaksi setara pemanasan antara dinatriumfosfat, Na2HPO4, dan mononatriumfosfat, NaH2PO4.
- Gambarkan struktur Lewis spesi ion (P3O10)–5 dan (P3O9)–3 dengan asumsi tidak terbentuk ikatan P-P.
- Dengan asumsi terbentuk koordinasi oktahedral dengan ion Mg2+, gambarkan ion (Mg(P3O10)(H2O)n)–3 dan tunjukkan pula berapakah nilai n.
- Tuliskan reaksi kesetimbangan antara ion Ca2+ dengan Na5P3O10 ketika terjadi pengikatan oleh deterjen dalam air sadah, dengan asumsi perbandingan aditif Na5P3O10terhadap ion Ca2+ adalah 1:1.
- Hitung berapa gram Na5P3O10 yang dibutuhkan untuk ditambahkan ke dalam mesin cuci berisi 20 L air untuk mengurangi ion Ca2+ dalam air ledeng (0,225 g/L) menjadi 0,02 g/L. Pengaruh pH, pengendapan Ca(OH)2 dan efek lainnya akibat ion positif lainnya dapat diabaikan. Diketahui
![K{_{1}} =\frac{[Ca^{2+}][P_{3}O_{10}^{-5}]}{[CaP_{3}O_{10}^{-5}]} K{_{1}} =\frac{[Ca^{2+}][P_{3}O_{10}^{-5}]}{[CaP_{3}O_{10}^{-5}]}](https://s0.wp.com/latex.php?latex=+K%7B_%7B1%7D%7D+%3D%5Cfrac%7B%5BCa%5E%7B2%2B%7D%5D%5BP_%7B3%7DO_%7B10%7D%5E%7B-5%7D%5D%7D%7B%5BCaP_%7B3%7DO_%7B10%7D%5E%7B-5%7D%5D%7D&bg=ffffff&fg=333333&s=0) = 1,0 × 10–3; Mr Na5P3O10= 368 dan Ar Ca = 40
= 1,0 × 10–3; Mr Na5P3O10= 368 dan Ar Ca = 40
Soal 5. Kinetika azometana (13 poin)
Gas azometana, CH3N=NCH3, pada 300oC terdekomposisi menjadi etana, C2H6, dan nitrogen, N2 . Berdasarkan eksperimen, telah ditentukan bahwa dekomposisi tersebut adalah order pertama. Waktu paruh untuk dekomposisi azometana adalah 1,02 detik pada 300°C. Sebanyak 45,0 mg sampel azometana ditempatkan dalam 300 mL wadah tertutup dan dipanaskan pada 300oC.
- Tuliskan persamaan reaksi dekomposisi azometana (2 poin)
- Tuliskan pernyataan hukum laju dekomposisi azometana. (3 poin)
- Berapa massa (milligram) azometana yang tersisa setelah 3,0 detik? (4 poin)
- Tentukan tekanan parsial gas nitrogen dalam wadah setelah 3,0 (4 poin)
Soal 6. Hidrokarbon tak jenuh dengan Halogen (22 poin)
Suatu hidrokarbon tidak jenuh A dapat bereaksi dengan halogen B membentuk produk senyawa C. Senyawa C ternyata masih dapat bereaksi dengan halogen B membentuk senyawa D yang jenuh. Senyawa C mengandung mol A sama dengan mol B sedangkan senyawa D mengandung mol B sama dengan dua kali mol A. Jika awalnya 6,5 g A direaksikan dengan 64 g B dan massa molekul relatif B adalah 6,153 kali massa molekul relatif A.
- Tentukan rumus kimia senyawa A dan B, kemudian gambarkan struktur kedua senyawa tersebut
- Tentukan rumus kimia senyawa C dan D dan gambarkan strukturnya
- Hitung pula massa setiap zat dalam satuan yang ada saat akhir













Post a Comment