hukum I dan II Faraday
Hukum I Faraday (1831 1832): massa zat yang dibebaskan pada elektrolisis (G) berbanding lurus dengan jumlah listrik yang digunakan (Q).
G=Q
Jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus (i) dengan waktu (t)
Q = i . t (coulomb)
Jadi persamaan di atas dapat dituliskan sebagai berikut:
G = it
Contoh
arus 1 amper yang dialirkan selama 1 menit (60 detik) ke dalam larutan CuSO4 mengendapkan 0,4 gram tembaga dikatode, maka:
a). Arus 2 amper dalam 1 menit (120 coulomb) akan mengendapkan 0,8 g Cu
b). Arus 1 amper dalam 2 menit (120 coulomb) akan mengendapkan 0,8 g Cu
c). Arus 2 amper dalam 2 menit (240 copulomb) akan mengendapkan 1,6 g Cu
Hukum II Faraday : “massa zat yang dibebaskan pada elektrolisis (G) berbanding lurus dengan massa ekivalen zat itu (ME)”.
G = ME
Massa ekivalen dari unsur-unsur logam sama dengan massa atom relatif (Ar) di bagi dengan perubahan bilangan oksidasinya (pbo)
ME= Ar/pbo
Contoh
Contoh pada elektrolisis larutan CuSO4 terjadi reduksi ion Cu2+ menjadi Cu
Cu2+(aq) + 2e –––→ Cu(s)
Oleh karena tembaga mengalami perubahan bilangan oksidasi sebesar 2, maka massa ekivalen
Cu = ArCu/2
= 63,5/2 = 31,75
Apabila listrik
yang sama banyak dialirkan kedalam dua atau lebih sel elektrolisis yang
berbeda, maka perbandingan massa zat-zat yang dibebaskan sama dengan
perbandingan massa ekivalennya.
Contoh
Misalkan arus i amper dialirkan selama t detik ke dalam larutan CuSO4
dan larutan AgNO3 yang di hubungkan seri.(pada hubungan seri jumlah
listrik yang memasuki kedua sel adalah sama). Listrik akan mengendapkan
Cu dan Ag pada katoda masing-masing sel. Sesuai dengan hukum faraday II,
perbandingan massa Cu dengan Ag yang di endapkan sama dengan
pebandingan massa ekivalennya.
GCu : Gag = ME Cu : MEAg
Misalkan massa Cu yang diendapkan 10 g maka massa perak dapat dihitung sebagai berikut:
GCu : Gag = ME Cu : MEAg
= 34,05 g
Penggabungan hukumfaraday I dan II menghasilkan persamaan sebagai berikut:
G = k . i . t . ME
Faraday menemukan harga faktor pembanding k =  jadi, persamaan diatas dapat dinyatakan sebagai berikut:
jadi, persamaan diatas dapat dinyatakan sebagai berikut:
Dengan
G = massa zat yang dibebaskan (dalam gram)
i = kuat arus (dalam amper)
t = waktu (dalam detik)
ME = massa ekivalen
Contoh soal
Hitunglah massa tembaga yang dapat dibebaskan oleh arus 10 amper yang
dialirkan selama 965 detik ke dalam larutan CuSO4 (Cu = 63,5)
Jawab:
Cu di endapkan di katoda menurut persamaan berikut ini:
Cu2+(aq) + 2e –––→ Cu (s)

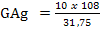



Post a Comment